Struktur Atom
1. Teori Atom DALTONTeori atom Dalton. Banyak sekali teori yang menjelaskan tentang definisi atom hingga saat ini. Teori atom yang paling tua dikenal adalah teori atom Dalton. Seperti yang Anda tahu, John Dalton adalah seorang guru sekolah di Inggris, yang mempublikasikan teorinya tentang atom di tahun 1808. Temuannya didasarkan pada eksperimen dan juga dari hukum kombinasi kimia.
Dalil Dalton
- Semua materi terdiri dari partikel yang tak dapat dibagi lagi yang disebut atom.
- Atom dari unsur yang sama adalah serupa dalam hal bentuk dan massa, tetapi atom unsur satu berbeda dari atom unsur lain.
- Atom tidak dapat diciptakan atau dihancurkan.
- Atom unsur yang berbeda dapat digabungkan satu sama lain dalam rasio tertentu untuk membentuk senyawa.
- Atom dari unsur yang sama dapat bergabung dalam lebih dari satu rasio untuk membentuk dua atau lebih senyawa.
- Atom adalah unit terkecil dari materi yang dapat berpengaruh terhadap reaksi kimia.
Kelemahan Teori Atom Dalton
- Ketidakterpisahan atom terbukti salah, karena, atom dapat dibagi lagi menjadi proton, neutron dan elektron. Namun atom adalah partikel terkecil, yang sangat berpengaruh dalam reaksi kimia.
- Menurut Dalton, atom-atom dari unsur yang sama adalah sama dalam segala hal. Pernyataan ini salah karena atom dari beberapa unsur berbeda dalam hal massa dan kepadatan. Atom seperti dari unsur yang sama memiliki massa yang berbeda disebut isotop. Misalnya, klorin memiliki dua isotop yang memiliki nomor massa 35 dan 37 satuan massa atom (sma).
- Dalton juga mengatakan atom elemen yang berbeda berbeda dalam segala hal. Hal ini telah terbukti salah dalam kasus-kasus tertentu seperti atom argon dan atom kalsium, yang memiliki massa atom yang sama yaitu 40. Atom unsur berbeda yang memiliki massa atom yang sama disebut isobar.
- Menurut Dalton atom unsur yang berbeda bergabung dalam rasio nomor sederhana keseluruhan untuk membentuk senyawa. Hal ini tidak terlihat pada senyawa organik kompleks seperti gula C12H22O11.
- Teori ini gagal untuk menjelaskan keberadaan alotrop. Perbedaan sifat arang, grafit, berlian tidak dapat dijelaskan karena ketiganya terdiri dari atom yang sama yaitu karbon.
Kelebihan Teori Atom Dalton
- Memungkinkan kita untuk menjelaskan hukum kombinasi kimia.
- Dalton adalah orang pertama yang mengakui perbedaan yang bisa diterapkan antara partikel dari suatu unsur (atom) dan dari senyawa (molekul).
2. Teori AtomTHOMSON
Pengertian Teori Atom Thomson
Teori Atom Thomson adalah salah satu teori yang mencoba mendeskripsikan bentuk atom yaitu seperti bentuk roti kismis. Diibaratkan sebagai roti kismis karena saat itu Thomson beranggapan bahwa atom bermuatan positif dengan adanya elektron bermuatan negatif di sekelilingnya. Perhatikan gambar berikut:Pada gambar di atas, bagian berwarna oranye bermuatan positif, sedangkan berwarna hijau adalah elektron yang bermuatan negatif.
Sampai akhir abad ke-19, konsep mengenai bentuk atom masih berupa bola pejal layaknya bola biliar. Sedangkan pada tahun 1987 Joseph John Thomson secara total merubah konsep atom dengan adanya penemuan elektron yang dikenal dengan teori atom Thomson.
Dalil Thomson
Sekiranya teori atom Thomson dapat diringkas sebagai berikut :- Atom berupa bola yang bermuatan positif dengan adanya elektron yang bermuatan negatif di sekelilingnya.
- Muatan positif dan negatif pada atom besarnya sama. Hal ini menjadikan atom bermuatan netral. Suatu atom tidak mempunyai muatan positif atau negatif yang berlebihan.
Penemuan Elektron
Elektron ditemukan oleh J.J. Thomson melalui percobaan tabung sinar katoda. Pada saat itu, Thomson melihat bahwa jika arus listrik melewati tabung vakum, ada semacam aliran berkilau yang terbentuk. Thomson menemukan bahwa aliran berkilau tersebut dibelokkan ke arah plat kutub positif. Teori atom Thomson membuktikan bahwa aliran tersebut terbentuk dari partikel kecil dari atom dan partikel terebut bermuatan negatif. Thomson menamai penemuan tersebut sebagai elektron.3. Teori Atom RUTHERFORD
Pengertian Teori Atom Rutherford
Teori atom Rutherford mengatakan bahwa atom mempunyai inti yang merupakan pusat massa yang kemudian dinamakan nukleus, dengan dikelilingi awan elektron bermuatan negatif.Dasar Teori Atom Rutherford
Teori atom Rutherford didasarkan pada eksperimen penembakan inti atom lempengan emas dengan partikel alfa yang dikenal dengan percobaan Geiger-Marsden. Pada saat itu, Rutherford menysun desain rancangan percobaan penembakan atom emas oleh partikel alfa yang dipancarkan oleh unsur radioaktif. Ternyata, sinar radioaktf tersebut ada yang dipantulkan, dibelokkan, dan diteruskan. Perhatikan gambar berikut:Seperti pada gambar di atas, Rutherford menjelaskan bahwa jika partikel alfa mengenai inti atom, maka akan terjadi tumbukan yang mengakibatkan pembelokan atau pemantulan partikel alfa. Hal itu disebabkan karena massa dan muatan atom terpusat pada inti (nukleus). Rutherford menyarankan bahwa muatan inti atom sebanding dengan massa atom dalam sma( satuan massa atom). Partikel alfa yang mengenai awan elektron tidak dibelokkan maupun dipantulkan.
Dalil Rutherford
Dari penjabaran di atas, maka sekiranya model atom Rutherford dapat disimpulkan sebagai berikut:- Sebagian besar volume atom merupakan ruang hampa.
- Massa atom terpusat di inti atom.
- Muatan atom terkonsentrasi pada pusat atom dengan volume yang sangat kecil. Kelipatan muatan ini sebanding dengan massa atom.
- Awan elektron tidak mempengaruhi penyebaran partikel alfa.
4. Teori Atom BOHR
Pengertian Teori Atom Bohr
Model
atom Bohr mengemukakan bahwa atom terdiri dari inti berukuran sangat
kecil dan bermuatan positif dikelilingi oleh elektron bermuatan negatif
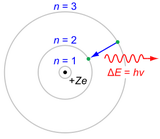
yang mempunyai orbit. Inilah gambar teori model atom Bohr. Penjelasan
teori atom Bohr dapat dibaca pada sub bunyi postulat teori atom Bohr di
bawah.
Model atom Bohr berbentuk seperti tata surya, dengan elektron yang berada di lintasan peredaran (orbit) mengelilingi inti bermuatan positif yang ukurannya sangat kecil. Gaya gravitasi pada tata surya secara matematis dapat diilustrasikan sebagai gaya Coulomb antara nukleus (inti) yang bermuatan positif dengan elektron bermuatan negatif.
Penjelasan Teori Atom Bohr
Niels Bohr mengajukan teori atom Bohr ini pada tahun 1915. Karena model atom Bohr merupakan modifikasi (pengembangan) dari model atom Rutherford, beberapa ahli kimia menyebutnya dengan teori atom Rutherford-Bohr. Walaupun teori atom Bohr ini mengalami perkembangan, namun kenyataannya model atom Bohr masih mempunyai kelemahan. Namun demikian, beberapa poin dari model atom Bohr dapat diterima. Tidak seperti teori atom Dalton maupun teori atom Rutherford, keunggulan teori atom Bohr dapat menjelaskan tetapan Rydberg untuk garis spektra emisi hidrogen. Itulah salah satu kelebihan teori atom Niels Bohr.Model atom Bohr berbentuk seperti tata surya, dengan elektron yang berada di lintasan peredaran (orbit) mengelilingi inti bermuatan positif yang ukurannya sangat kecil. Gaya gravitasi pada tata surya secara matematis dapat diilustrasikan sebagai gaya Coulomb antara nukleus (inti) yang bermuatan positif dengan elektron bermuatan negatif.
Bunyi Postulat Teori Atom Bohr
Teori atom Bohr kiranya dapat dijelaskan seperti berikut:- Elektron mengitari inti atom dalam orbit-orbit tertentu yang berbentuk lingkaran. Orbit-orbit ini sering disebut sebagai kulit-kulit elektron yang dinyatakan dengan notasi K, L, M, N ... dst yang secara berututan sesuai dengan n = 1, 2, 3, 4 ... dst.
- Elektron dalam tiap orbit mempunyai energi tertentu yang makin tinggi dengan makin besarnya lingkaran orbit atau makin besarnya harga n. Energi ini bersifat terkuantisasi dan harga-harga yang diijinkan dinyatakan oleh harga momentum sudut elektron yang terkuantisasi sebesar n (h/2π) dengan n = 1, 2, 3, 4 ... dst.
- Selama dalam orbitnya, elektron tidak memancarkan energi dan dikatakan dalam keadaan stasioner. Keberadaan elektron dalam orbit stasioner ini dipertahankan oleh gaya tarik elektrostatik elektron oleh inti atom yang diseimbangkan oleh gaya sentrifugal dari gerak elektron.
- Elektron dapat berpindah dari orbit satu ke orbit lain yang mempunyai energi lebih tinggi bila elektron tersebut menyerap energi yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan, dan sebaliknya bila elektron berpindah ke orbit yang mempunyai energi lebih rendah akan memancarkan energi radiasi yang teramati sebagai spektrum garis yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan.
- Atom dalam molekul dikatakan dalam keadaan tingkat dasar (ground state) apabila elektron-elektronnya menempati orbit-orbit sedemikian sehingga memberikan energi total terendah. Dan apabila elektron-elektron menempati orbit-orbit yang memberikan energi lebih tinggi daripada energi tingkat dasarnya dikatakan atom dalam tingkat tereksitasi (excited state). Atom dalam keadaan dasar lebih stabil daripada dalam keadaan tereksitasi.
Model Hidrogen Bohr
Contoh paling sederhana dari model atom hidrogen Bohr (Z = 1) atau sebuah ion mirip hidrogen (Z > 1), yang mempunyai elektron bermuatan negatif mengelilingi inti bermuatan positif. Energi elektromagnetik akan diserap atau dilepaskan ketika sebuah elektron berpindah dari lintasan satu ke lintasan lain. Jari-jari dari lintasan bertambah sebagai n2, dimana n adalah bilangan kuantum utama. Transisi dari 3 ke 2 menghasilkan garis pertama dalam deret Balmer. Untuk hidrogen (Z = 1) akan menghasilkan foton dengan panjang gelombang 656 nm (cahaya merah).Kelemahan Teori Atom Bohr
Walaupun dinilai sudah revolusioner, tetapi masih ditemukan kelemahan teori atom Bohr yaitu:- Melanggar asas ketidakpastian Heisenberg karena elektron mempunyai jari-jari dan lintasan yang telah diketahui.
- Model atom Bohr mempunyai nilai momentum sudut lintasan ground state yang salah.
- Lemahnya penjelasan tentang prediksi spektra atom yang lebih besar.
- Tidak dapat memprediksi intensitas relatif garis spektra.
- Model atom Bohr tidak dapat menjelaskan struktur garis spektra yang baik.
- Tidak dapat menjelaskan efek Zeeman.
5. Teori MEKANIKA KUANTUM
Walaupun teori Bohr
telah melukiskan struktur atom cukup detil, namun masih ada sesuatu
yang hilang. Untuk ini perlu kiranya ditinjau kembali mengenai sifat
cahaya. Para ilmuwan selalu saja mendapat kesulitan dalam melukiskan
sifat karakteristik cahaya. Banyak percobaan dengan jelas menunjukkan
bahwa cahaya bersifat gelombang, tetapi pada percobaan lain menunjukkan
bahwa cahaya bersifat sebagai partikel (yang nantinya dikenal sebagai aliran foton yang membawa paket-paket energi atau sejumlah energi diskret terkuantisasi), sebagaimana terjadi pada berbagai jenis gejala.
Dari perbandingan gejala-gejala tersebut dapat dipertimbangkan bahwa sifat cahaya atau energi radiasi secara umum berhubungan dengan sifat gelombang dan sifat partikel atau sering dikenal sebagai dualisme cahaya yaitu sifat gelombang partikel. Dalam hal seperti ini, sejumlah asumsi kemudian merupakan dasar pengembangan teori kuantum dapat dirumuskan sebagai berikut:
n = bilngan kuantum atau diskret
v = frekuensi osilator).
Dari perbandingan gejala-gejala tersebut dapat dipertimbangkan bahwa sifat cahaya atau energi radiasi secara umum berhubungan dengan sifat gelombang dan sifat partikel atau sering dikenal sebagai dualisme cahaya yaitu sifat gelombang partikel. Dalam hal seperti ini, sejumlah asumsi kemudian merupakan dasar pengembangan teori kuantum dapat dirumuskan sebagai berikut:
- Atom-atom berkelakuan sebagai osilator, menghasilkan gelombang elektromagnetik dengan frekuensi gelombang yang karakteristik bagi atom yang bersangkutan.
- Energi tidak dibawa oleh gelombang itu sendiri melainkan oleh foton yang kecepatan alirnya diberikan oleh intensitas gelombang yang bersangkutan.
- Kecepatan pancaran gelombang oleh osilator-osilator menentukan peluang pancaran foton oleh sumbernya.
E = nhv
dengan:n = bilngan kuantum atau diskret
v = frekuensi osilator).
5. BILANGAN KUANTUM
Pengertian Bilangan Kuantum
Bilangan kuantum adalah suatu nilai yang menjelaskan kuantitas kekal
dalam sistem dinamis. Bilangan kuantum menggambarkan sifat orbital dan
elektron dalam orbital.
Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Untuk sebuah atom, nilai bilangan kuantum utama berkisar dari 1 ke tingkat energi yang mengandung elektron terluar. Bilangan kuantum utama mempunyai nilai sebagai bilangan bulat positif 1, 2, 3, dst. Nilai-nilai tersebut melambangkan K, L, M, dst.
Bilangan kuantum azimut juga berhubungan dengan jumlah subkulit. Nilai ini menggambarkan subkulit yang dimana elektron berada. Untuk subkulit s, p, d, f, bilangan kuantum azimut berturut-turut adalah 0, 1, 2, 3.
Bilangan kuantum magnetik ada karena momentum sudut elektron, gerakannya berhubungan dengan aliran arus listrik. Karena interaksi ini, elektron menyesuaikan diri di wilayah tertentu di sekitar inti. Daerah khusus ini dikenal sebagai orbital. Orientasi elektron di sekitar inti dapat ditentukan dengan menggunakan bilangan kuantum magnetik m.
Nilai positif atau negatif dari spin menyatakan spin atau rotasi partikel pada sumbu. Sebagai contoh, untuk nilai s = +½ berarti berlawanan arah jarum jam (ke atas), sedangkan s = -½ berarti searah jarum jam (ke bawah). Diambil nilai setengah karena hanya ada dua peluang orientasi, yaitu atas dan bawah. Dengan demikian, peluang untuk mengarah ke atas adalah 50% dan peluang untuk mengarah ke bawah adalah 50% .
Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Macam-Macam Bilangan Kuantum
Untuk menjelaskan elektron secara lengkap dibutuhkan empat macam bilangan kuantum, yaitu:- Bilangan kuantum utama (n) yang menyatakan tingkat energi.
- Bilangan kuantum azimut (ℓ) yang menyatakan bentuk orbital.
- Bilangan kuantum magnetik (m) yang menyakatakan orientasi orbital dalam ruang tiga dimensi.
- Bilangan kuantum spin (s) yang menyatakan spin elektron pada sebuah atom.
Penjelasan Bilangan Kuantum
Bilangan kuantum utama
Bilangan kuantum utama (primer) digunakan untuk menyatakan tingkat energi utama yang dimiliki oleh elektron dalam sebuah atom. Bilangan kuantum utama tidak pernah bernilai nol. Semakin tinggi nilai n semakin tinggi pula energi elektron.Untuk sebuah atom, nilai bilangan kuantum utama berkisar dari 1 ke tingkat energi yang mengandung elektron terluar. Bilangan kuantum utama mempunyai nilai sebagai bilangan bulat positif 1, 2, 3, dst. Nilai-nilai tersebut melambangkan K, L, M, dst.
| Kulit | K | L | M | N | O |
| Nilai n | 1 | 2 | 3 | 4 | 5 |
Bilangan kuantum azimut
Bilangan kuantum azimut sering disebut dengan bilangan kuantum angular (sudut). Energi sebuah elektron berhubungan dengan gerakan orbital yang digambarkan dengan momentum sudut. Momentum sudut tersebut dikarakterisasi menggunakan bilangan kuantum azimut. Bilangan kuantum azimut menyatakan bentuk suatu orbital dengan simbol ℓ.Bilangan kuantum azimut juga berhubungan dengan jumlah subkulit. Nilai ini menggambarkan subkulit yang dimana elektron berada. Untuk subkulit s, p, d, f, bilangan kuantum azimut berturut-turut adalah 0, 1, 2, 3.
Bilangan kuantum magnetik
Bilangan kuantum magnetik menyatakan tingkah laku elektron dalam medan magnet. Tidak adanya medan magnet luar membuat elektron atau orbital mempunyai nilai n dan ℓ yang sama tetapi berbeda m. Namun dengan adanya medan magnet, nilai tersebut dapat sedikit berubah. Hal tersebut dikarenakan timbulnya interaksi antara medan magnet sendiri dengan medan magnet luar.Bilangan kuantum magnetik ada karena momentum sudut elektron, gerakannya berhubungan dengan aliran arus listrik. Karena interaksi ini, elektron menyesuaikan diri di wilayah tertentu di sekitar inti. Daerah khusus ini dikenal sebagai orbital. Orientasi elektron di sekitar inti dapat ditentukan dengan menggunakan bilangan kuantum magnetik m.
| Kulit (n) | Subkulit (l) | Nama Orbital (nl) | Orientasi (m1) | Jumlah Orbital | Maksimum Terisi |
| n = 1 | l = 0 | 1s | ml = 0 | 1 | 2 e- |
| n = 2 | l = 0 | 2s | ml = 1, 0-1 | 1 | 2 e- |
| l = 1 | 2p | ml = 1, 0-1 (or px, py, pz) | 3 | 6 e- | |
| n = 3 | l = 0 | 3s | ml = 0 | 1 | 2e- |
| l = 1 | 3p | ml = 1, 0-1 | 3 | 6 e- | |
| l = 2 | 3d | ml = 2, 1, 0, -1, -2 (or dxy, dyz, dxz) | 5 | 10 e- |
Bilangan kuantum spin
Bilangan kuantum spin menyatakan momentum sudut suatu partikel. Spin mempunyai simbol s atau sering ditulis dengan ms (bilangan kuantum spin magnetik). Suatu elektron dapat mempunyai bilangan kuantum spin s = +½ atau –½.Nilai positif atau negatif dari spin menyatakan spin atau rotasi partikel pada sumbu. Sebagai contoh, untuk nilai s = +½ berarti berlawanan arah jarum jam (ke atas), sedangkan s = -½ berarti searah jarum jam (ke bawah). Diambil nilai setengah karena hanya ada dua peluang orientasi, yaitu atas dan bawah. Dengan demikian, peluang untuk mengarah ke atas adalah 50% dan peluang untuk mengarah ke bawah adalah 50% .









0 komentar:
Posting Komentar