Sistem Periodik Unsur
1.Kimia UnsurUnsur-unsur dapat diklasifikasikan menurut banyak cara, yang paling tegas adalah atas dasar wujud pada keadaan Standard Ambient Temperature and Pressure (25o C, 100 kPa), atau biasa disebut dengan SATP. SATP berbeda dengan STP (Standard Temperature and Pressure) yang merujuk pada temperatur 0o C dan 101 kPa. Atas dasar SATP, unsur-unsur dibedakan dalam wujud gas yaitu ada sebelas unsur, hidrogen, nitrogen, oksigen, fluorin, klorin, dan gas mulia. Wujud cair yaitu hanya unsur bromin dan merkuri. Dan sisanya adalah wujud padat. Klasifikasi wujud fisik demikian ini tentu tidak memberikan banyak aspek kimiawinya.
Klasifikasi lain yang sangat umum adalah berdasarkan dua kelompok logam atau metal dan nonlogam atau nonmetal. Namun pertanyaan yang muncul adalah apakah yang dimaksud dengan logam / nonlogam? Permukaan mengkilat ternyata bukan merupakan kriteria yang tepat bagi logam karena silikon dan iodin yang sering diklasifikasikan sebagai nonlogam ternyata permukannya bisa mengkilap. Rapatan juga bukan kriteria yang tepat, misalkan litium yang diklasifikasikan sebagai logam ternyata rapatan hanya setengah rapatan air sedangkan osmium sebagai logam mempunyai rapatan 40 kali rapatan litium. Kekerasan juga bukan indikator yang tepat, sebab logam-logam alkali bersifat lunak. Sifat mudah ditempa menjadi lembaran dan menjadi kawat sering dipakai sebagai kriteria sifat logam, namun beberapa logam transisi bersifat rapuh, mudah pecah. Sifat penghantar panas yang tinggi juga dipakai untuk menyatakan kelompok logam, namun misalnya intan (C) yang diklasifikasikan sebagai non logam ternyata merupakan unsur terkeras dan juga merupakan unsur penghantar panas tertinggi. Barangkali, sifat penghantar listrik merupakan kriteria yang terbaik bagi logam, meskipun plutonium merupakan penghantar terburuk kira-kira seperseratus kali penghantar listrik terbaik, yaitu perak.
Klasifikasi tersebut jelas lebih banyak menekankan pada sifat-sifat fisik dan bagi para ahli kimia, sifat unsur yang paling penting adalah pola sifat kimiawinya, misalnya secara khusus kecenderungan terhadap pembentukan ikatan kovalen atau pemilihan pembentukan kation. Kriteria manapun yang dipakai, beberapa unsur selalu terklasifikasi ke dalam "daerah batas" model klasifikasi logam-nonlogam. Para ahli kimia anorganik umumnya setuju bahwa unsur-unsur boron, silikon, germanium, arsen, dan telurium termasuk dalam daerah batas ini yang sering disebut daerah batas yang menunjukkan sifat-sifat kimiawi mirip dengan semilogam. Yang termasuk unsur-unsur semilogam adalah Be, Al, Zn, Ga, Sn, Pb, Sb, Bi, dan Po.
Hubungan antara tabel sistem periodik unsur dengan sifat-sifat kimiawi serta konfigurasi elektronik unsur-unsur yang bersangkutan menyarankan adanya bermacam-macam klasifikasi.
2.Golongan Unsur Gas Mulia
Kelompok unsur-unsur inert yang sering disebut juga unsur-unsur gas mulia (noble gases) terdiri atas 2He, 10Ne, 18Ar, 36Kr, 54Xe, dan 86Rn. Kecuali He yang mempunyai konfigurasi penuh 1s2, kelompok unsur ini ditandai dengan konfigurasi elektronik penuh untuk setiap orbital dan dengan elektron valensi ns2 np6.
Karakteristik pada orbital kulit terluar inilah yang biasanya dikaitkan dengan sifat inert (lembam) unsur-unsur yang bersangkutan, yaitu sangat stabil dalam arti sukar bereaksi dengan unsur-unsur lain. Namun demikian akhir-akhir ini telah berhasil dibuat beberapa senyawa xenon dan kripton seperti XeF2, XeF4, XeF6, XeO4, dan KrF2.
Unsur-unsur inert ini sering juga diklasifikasikan sebagai golongan nol karena sifat kestabilan yang tinggi, namun lebih sering diklasifikasikan sebagai golongan VIII utama atau M8. Perlu dicatat bahwa konfigurasi elektronik unsur-unsur gas mulia dianggap sudah penuh, dan oleh karenanya dipakai sebagai standar untuk menyatakan penuh atau tidak-penuhnya konfigurasi elektronik kelompok unsur-unsur lain.
Perbandingan beberapa sifat unsur
Karakteristik pada orbital kulit terluar inilah yang biasanya dikaitkan dengan sifat inert (lembam) unsur-unsur yang bersangkutan, yaitu sangat stabil dalam arti sukar bereaksi dengan unsur-unsur lain. Namun demikian akhir-akhir ini telah berhasil dibuat beberapa senyawa xenon dan kripton seperti XeF2, XeF4, XeF6, XeO4, dan KrF2.
Unsur-unsur inert ini sering juga diklasifikasikan sebagai golongan nol karena sifat kestabilan yang tinggi, namun lebih sering diklasifikasikan sebagai golongan VIII utama atau M8. Perlu dicatat bahwa konfigurasi elektronik unsur-unsur gas mulia dianggap sudah penuh, dan oleh karenanya dipakai sebagai standar untuk menyatakan penuh atau tidak-penuhnya konfigurasi elektronik kelompok unsur-unsur lain.
Perbandingan beberapa sifat unsur
| Unsur | Konfigurasi Elektronik |
|---|---|
| Be | [He] 2s2 |
| Mg | [Ne] 3s2 |
| Ca | [Ar] 4s2 |
| Sr | [Kr] 5s2 |
| Ba | [Xe] 6s2 |
| Ra | [Rn] 7s2 |
| Zn | [Ar] 3d10 4s2 |
| Cd | [Kr] 4d10 5s2 |
| Hg | [Xe] 4f14 5d10 6s2 |
Catatan :
Dalam beberapa hal, Hg mempunyai sifat-sifat yang unik, jauh berbeda dengan Zn dan Cd misalnya potensial elektrode yang jauh berharga positif, berupa cairan pada suhu kamar dan mempunyai konfigurasi elektronik dengan orbital 4f14 terisi penuh.
3.Golongan Unsur UtamaUnsur-unsur golongan utama atau representatif ditandai dengan konfigurasi elektronik tidak-penuh pada satu kulit terluar ns1 - ns2 np(4-5). Unsur-unsur 30Zn, 48Cd, dan 80Hg masing-masing mempunyai konfigurasi elektronik [18Ar] 3d10 4s2, [36Kr] 4d10 5s2 dan [54Xe] 4f14 5d10 6s2. Unsur-unsur ini dapat membentuk ion M2+ seperti unsur-unsur golongan M2 dengan beberapa kemiripan, namun dengan perbedaan sifat-sifat diantara kedua kelompok ini. Salah satu perbedaannya adalah bahwa unsur-unsur Zn dan Cd mempunyai sifat kecenderungan yang lebih besar untuk membentuk senyawa-senyawa kompleks dengan NH3, ion-ion halida (X-) dan CN-.
Perbedaan sifat-sifat di antara kedua kelompok ini mungkin disebabkan oleh konfigurasi elektronik terluar yaitu 18 elektron bagi ion M2+ untuk kelompok ini. Dengan penuhnya elektron (d10) untuk kelompok ini diduga ada hubungannya dengan sifat polarisasi ion M2+ yang jauh lebih besar daripada sifat polarisasi ion-ion divalen dari kelompok M2 sebagai akibat sifat orbital d yang mudah mengalami distorsi. Oleh karena itu ketiga unsur tersebut sering dinyatakan pula sebagai kelompok unsur-unsur utama tetapi dengan notasi M2'.
4.Golongan Unsur Transisi
Kelompok unsur transisi. Batasan mengenai unsur transisi masih sering diperdebatkan. Dari satu sisi, unsur-unsur transisi mencakup seluruh unsur-unsur dengan orbital nd(1-10) "sedang diisi elektron" menurut prinsip Aufbau. Secara umum, batasan ini memberikan karakteristik konfigurasi elektronik (n-1)d(1-10) ns(1-2), dan dengan demikian unsur-unsur dengan konfigurasi elektronik .....(n-1)d(1-10) ns2 yaitu Zn, Cd, dan Hg termasuk di dalamnya.
Sebaliknya pandangan lain, yang lebih banyak diikuti para ahli kimia, mempertimbangkan bahwa ketiga unsur kelompok terakhir ini mempunyai sifat-sifat yang berbeda dari umumnya sifat-sifat kelompok usnur-unsur transisi, misalnya dalam hal sifat magnetis dan warna. Oleh karena itu, ketiga unsur tersebut tidak dapat dipertimbangkan sebagai unsur-unsur transisi. Dengan demikian unsur-unsur transisi kemudian menunjuk pada unsur-unsur dengan konfigurasi elektronik belum penuh pada salah satu atau kedua kulit terluar yang melibatkan orbital d dengan karakteristik konfigurasi elektronik (n-1)d(1-10) ns(1-2). Jadi jelas bahwa dengan batasan demikian ini ketiga unsur tersebut (Zn, Cd, Hg) tidak termasuk sebagai unsur transisi. Kedua batasan ini dengan mudah dapat dibandingkan sebagai berikut:
| Kelompok Transisi, d | Unsur menurut batasan pertama | Unsur menurut batasan kedua |
|---|---|---|
| I (pertama) | Sc - Zn | Sc - Cu |
| II (kedua) | Y- Cd | Y - Ag |
| III (ketiga) | La, dan Hf - Hg | La, dan Hf - Au |
Perlu dicatat bahwa untuk kelompok transisi seri III tersebut anggota pertamanya adalah 57La (.... 5d1) dan setelah melompati kelompok unsur transisi dalam (4f) baru disambung anggota yang kedua, 72Hf dan seterusnya. Dalam hal ini kelompok unsur 4f adalah 58Ce - 71Lu, dan kelompok 5f adalah 90Th - 103Lr. Versi lain menyarankan bahwa 71Lu (.... 5d1) merupakan anggota pertama sehingga tidak terjadi lompatan, dan konsekuensinya adalah bahwa kelomok unsur 4f terdiri atas 57La - 70Yb dan kelompok unsur 5f terdiri atas 89Ac - 102No. Hal yang sangat penting adalah adanya pengecualian atau penyimpangan konfigurasi elektronik terhadap prinsip Aufbau untuk beberapa unsur transisi. Penyimpangan konfigurasi elektronik tersebut sering dihubungkan dengan kestabilan bagi sistem orbital penuh dan setengah penuh.
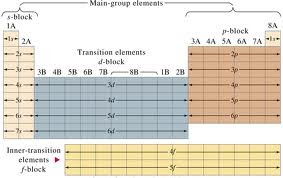
5.Organisasi Tabel Periodik Unsur
Dalam tabel periodik unsur (TPU) modern, unsur-unsur ditempatkan secara teratur menurut naiknya nomor atom atau jumlah proton. Ada cukup banyak desain bentuk TPU, namun yang paling umum dijumpai adalah bentuk pendek dan bentuk panjang. Bentuk panjang memang benar-benar terlalu panjang karena tampilan langsung kedua seri unsur-unsur ini masing-masing mempunyai kemiripan sifat-sifat kimiawi. Inilah tabel periodik unsur bentuk panjang.
Maka dari itu keduanya lebih praktis ditampilkan secara terpisah di bagian bawah sehingga diperoleh bentuk tabel pendek yang lebih kompak.
Menurut rekomendasi Interntional Union of Pure and Applied Chemistry (IUPAC) penomoran golongan unsur-unsur dari 1 hingga 18, hidrogen ditempatkan tersendiri terpisah tidak masuk golongan manapun karena sifatnya yang unik. Sistem ini menggantikan sistem lama yang menggunakan notasi dari kombinasi angka dan huruf Romawi yang membingungkan karena perbedaan penomoran antara Amerika Utara dengan yang lainnya. Sebagai contoh, di Amerika Utara golongan IIIB merujuk pada golongan skandinavium, Sc, sedangkan di tempat lain nomor ini merujuk pada golongan boron, B. Penomoran golongan ini tidak diberlakukan pada unsur-unsur lantanoida dan aktinoida karena kemiripan unsur-unsur tersebut dalam periode (lajur mendatar) daripada golongan (lajur vertikal).
Golongan 1 dan 2 dan 13-18 mewakili golongan utama. Golongan ini terdiri atas kelompok s dan kelompok p, artinya secara berurutan dalam kelompok masing-masing orbital s dan orbital p dari atom yang bersangkutan sedang diisi elektron untuk memperoleh konfigurasi elektronik menurut aturan Aufbau.










0 komentar:
Posting Komentar